|
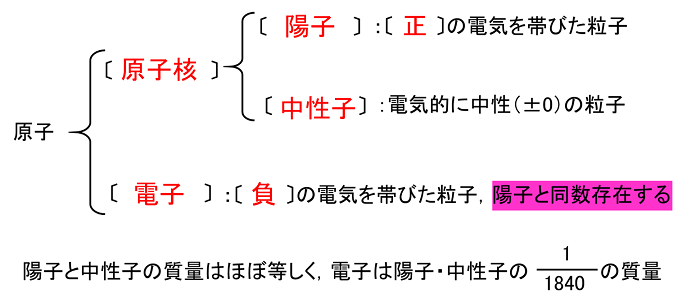
原子は直径がおおよそ〔 10−10m 〕の非常に小さな粒子である。原子は1つの〔 原子核 〕が中心に存在し,その周りにいくつかの〔 電子 〕が存在する構造となっている。原子核はさらに〔 陽子 〕と〔 中性子 〕からできている。
|
 |
|
原子番号と質量数
水素原子や銅原子といった原子の種類(元素)は,〔 陽子 〕の数によって決まる。この陽子の数をその元素の〔 原子番号 〕という。また原子の質量を考えた場合,陽子1個と中性子1個の質量はほぼ等しく,電子1個の質量は陽子や中性子の約〔 1/1840 〕しかないので,原子の質量はほぼ原子核の質量(陽子と中性子の質量の和)と等しくなる。そこで,陽子数と中性子数の和をその原子の〔 質量数 〕という。中性子の数は,元素によって決まってはいない。質量数や原子番号は,左下の図のように元素記号の左側の上下につけて示す。
|
 |
|
粒子の電荷
陽子は〔 正 〕に電子は〔 負 〕の電気を帯びている。陽子1個と電子1個の電荷(電気の量)の絶対値は等しく,陽子が+1なら電子は−1となる。そのため,陽子1個と電子1個で互いの電荷を打消し合う(±0になる)。原子には陽子の数と同じだけの電子が存在するので原子全体では電気的に〔 中性 〕となる。モデル図を右上に示す。この原子は陽子が2個だから〔 He 〕である。
例題 次の原子を構成する陽子の数,電子の数,中性子の数をそれぞれ答えよ。
|
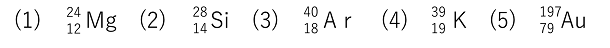 |
| (1) 陽子12 電子12 中性子12 (2) 陽子14 電子14 中性子14
(3) 陽子18 電子18 中性子22 (4) 陽子19 電子19 中性子20
(5) 陽子79 電子79 中性子118
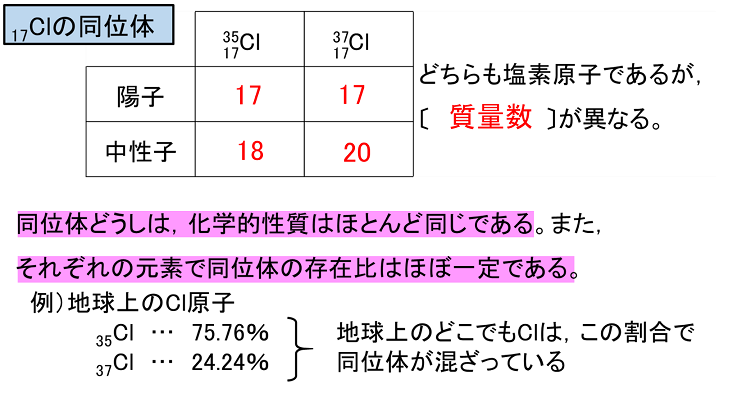
【同位体】
原子には原子番号(陽子の数)が同じでも,中性子数が異なるため質量数が異なるものが存在する。原子番号が同じなので,同じ元素ではあるが,質量が異なる原子が存在することになる。このような同じ元素の原子で質量数が異なる原子を互いに〔 同位体 〕またはアイソトープという。同位体どうしは,化学的性質はほとんど同じである。また,それぞれの元素で同位体の存在比はほぼ一定である。
|
 |
| 同位体の中には,中性子が多いため壊れやすく,放射線を出して崩壊し別の原子核に変わるものもありこれを〔 放射性同位体 〕またはラジオアイソトープという。放射性同位体は壊れる時間(速度)が一定であり,元の量の半分になる時間をその放射性同位体の〔 半減期 〕という。たとえば,14Cは放射性同位体で,炭素原子全体の0.01%程度存在する。14Cの半減期は5730年である。生きている生物は常に代謝をしているのでこの割合が保たれるが,死んでいる場合は,徐々に14Cが減少していく。古代遺跡の木材(死んでいる木)などは,14Cの割合を調べることによって何年前の木材か計算(推定)することができる。14Cが0.005%なら〔 5730 〕年前のものと判断できる。 |
|
|
|
|
 |
|
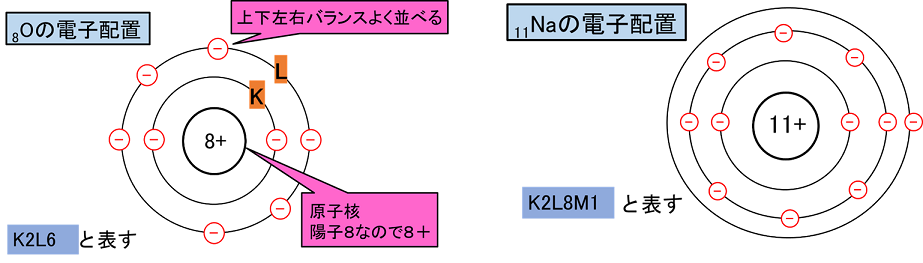
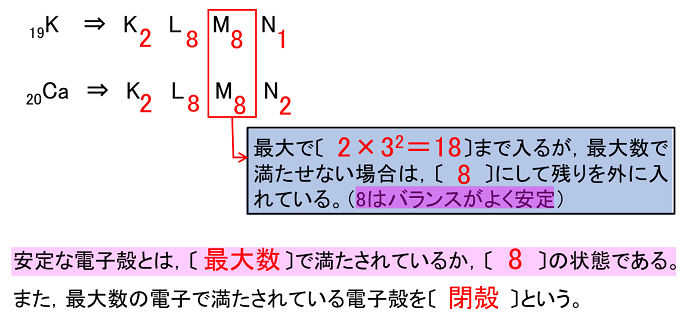
19Kや20Caなどの電子配置は基本的には,1H〜18Arと同じだが,最も外側の電子殻の配置が異なるので注意する。
|
 |
|
価電子
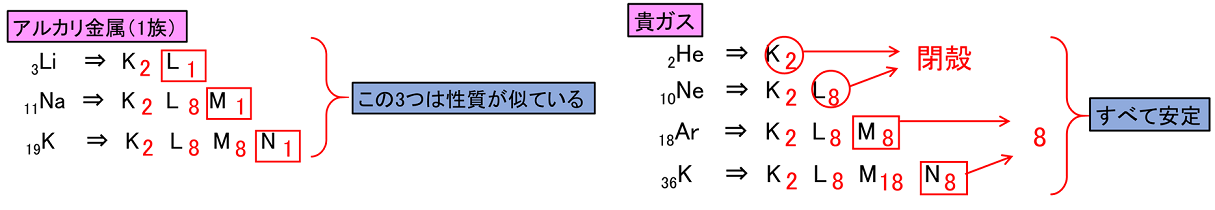
原子の最外殻の電子を〔 価電子 〕という。最外殻の電子は,原子が反応したり,結合したりするときに使われる。そのため,価電子の数が同じ原子は化学的性質が似る。
貴ガス(2He,10Ne,18Ar,36Kr,…)の原子は他の原子と反応したり,結合したりしない。化学的に安定な性質である。貴ガスの電子配置を考えてみると,なぜ安定なのかがわかる。
|
 |
|
そのため,貴ガスの価電子数は〔 0 〕と示す。最外殻の電子数といった場合は,2や8と示すので注意。他の原子では「価電子数=最外殻の電子数」となる。
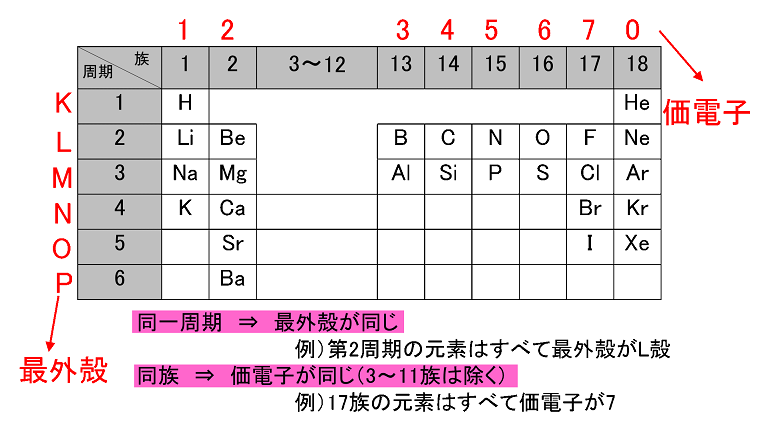
周期表と電子配置
|
 |
|
例題 次の原子の電子配置を例にならって示せ。また,それぞれの最外殻電子の数と価電子の数を記せ。例)Cl K2L8M7
(1) Al (2) Ar (3) C (4) Ca (5) He (6) S
(1) K2L8M3 最外殻3 価電子3 (2) K2L8M8 最外殻8 価電子0
(3) K2L4 最外殻4 価電子4 (4) K2L8M8N2 最外殻2 価電子2
(5) K2 最外殻2 価電子0 (6) K2L8M6 最外殻6 価電子6
|
 |